MTT的应用
MTT法又称MTT比色法,是一种检测细胞存活和生长的方法。该方法已广泛用于一些生物活性因子的活性检测、大规模的抗肿瘤药物筛选、细胞毒性试验以及肿瘤放射敏感性测定等。它的特点是灵敏度高、经济。但是它的缺点也很多,如果操作和数据处理方法不当,结果可信度和可重复性很低。
MTT主要有两个用途
1.药物(也包括其他处理方式如放射线照射)对体外培养的细胞毒性的测定;
2.细胞增殖及细胞活性测定。
MTT的原理
MTT商品名:噻唑蓝,是一种黄颜色的染料。
检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT 还原为水不溶性的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)能溶解细胞中的甲瓒,用酶联免疫检测仪在490nm波长处测定其光吸收值,可间接反映活细胞数量。在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。根据测得的吸光度值(OD值),来判断活细胞数量,OD值越大,细胞活性越强(如果是测药物毒性,则表示药物毒性越小)。
MTT工作浓度为5mg/ml。因此,可以称取MTT0.5克,溶于100ml的磷酸缓冲液(PBS)或无酚红的培养基中,用0.22μm 滤膜过滤以除去溶液里的细菌,放-20℃避光保存即可。
实验步骤
1)铺板,使用96孔板,每孔细胞密度控制在4000-5000个,体积100μl每孔。
2)5%CO2,37℃孵育,正常4到6小时贴壁后即可,加入浓度梯度的药物。
3)5%CO2,37℃孵育16-48小时,倒置显微镜下观察。
4)每孔加入20µlMTT溶液(5mg/ml,即0.5%MTT),继续培养4h。若药物与MTT反应,可先离心后弃去培养液,小心用PBS冲2-3遍后,再加入含MTT的培养液。
5)终止培养,一次性像泼水一样,直接泼掉孔中的液体。
6)每孔加入150µl二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪OD490nm处测量各孔的吸光值。
试剂材料准备与实验仪器
1)对数生长期细胞
2)受试因素(药物)
3)MTT:以PBS配制成5mg/ml,抽滤除菌,保存在4˚C
4)DMSO(二甲基亚砜)
5)96孔板
6)酶联免疫检测仪
7)细胞培养箱
常用铺板方法
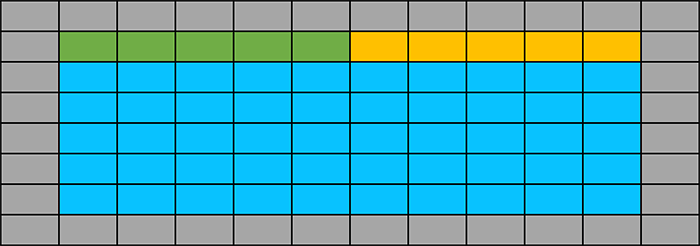
灰色为边缘孔,加入无菌PBS;绿色为空白组,不加细胞,只加入培养基和MTT。
黄色为对照组,加入细胞,不加药;蓝色为实验组,加入细胞和药物。
实验注意事项
MTT实验的主要缺点在于如果操作和数据处理方法不当,结果可信度和可重复性很低,以拟合化合物IC50为例介绍操作中注意事项:
1)严格控制铺板密度和给药浓度(对结果影响最大)
96孔板孔径很小,如果细胞密度过大,药物对肿瘤的抑制作用作用越小。同时,收样前,对照组孔内如果已经长满细胞,就不能模拟出48小时后细胞的真实数量,对结果也有影响。
根据经验,建议铺板时每孔细胞个数在4000左右,给药时细胞密度控制在30%左右。孔底的细胞一定要均匀分布。
2)注意边缘效应
细胞培养过程中,边孔水分蒸发很快,因此边孔内药物浓度会浓缩,细胞状况会更复杂。因此铺板只用中间60孔,边缘36孔加入无菌PBS。
3)给药浓度
为拟合IC50,通常设置10个给药浓度,每种浓度5个复孔。收样时,最高浓度孔内细胞一定要抑制率能够达到90以上,并且同时有2个及以上点抑制率都能达到90%以上。
4)避光操作
MTT一般4度保存两周,注意避光保存,或配制成5mg/ml保存在-20度长期保存,避免反复冻融,最好小剂量分装,用避光袋或是黑纸、锡箔纸包住避光以免分解,配制完后可过滤一下。
5)培养液
贴壁细胞加MTT前吸掉培养液,悬浮细胞可以不吸除培养液,再加入 0.5%MTT,量为20ul/孔。
结果分析
将各孔OD值减去本底OD值(培养基+MTT+DMSO,不含细胞)或者对照组OD值,各个复孔取平均值±SD值即为最终结果。
改良寇式法:lgIC50=Xm-I(P-(3-Pm-Pn)/4)
Xm:lg 最大剂量
I:lg(最大剂量/相临剂量)
P:阳性反应率之和
Pm:最大阳性反应率
Pn:最小阳性反应率
举个例子:各药物浓度作用于某肿瘤细胞后所得MTT值如下:
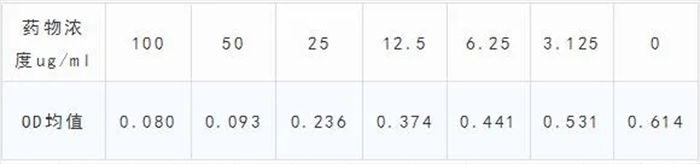
公式中的最大最小阳性反应率就是最大最小抑制率
抑制率=1-加药组OD值/对照组OD值,如对于100ug/ml的药物,其抑制率=1-0.080/0.614=0.869,各组抑制率如下:
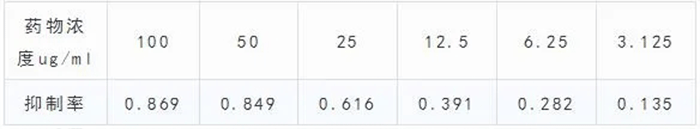
代入计算公式:
Pm=0.869
Pn=0.135
P=0.869+0.849+0.616+0.391+0.282+0.135=3.142
Xm=lg100=2
lgI=lg100/50=0.301
lgIC50=2-0.301*(3.142-(3-0.869-0.135)/4)=1.655
IC50=45.186
该药物的IC50值为45.186ug/ml


